Faut-il relâcher le « gene drive » dans la nature ?
Enjeux civilisationnels des « OGMs sauvages »
BAPTISTE
MORIZOT1 et VIRGINIE
ORGOGOZO2
Éradiquer le paludisme, qui tue plus de 500 000 personnes par an, ainsi que les autres maladies transmises par les moustiques. Faire disparaître les algues du genre Caulerpa et toutes les autres espèces invasives qui causent tant de dégâts écologiques, matériels et économiques. Empêcher l'apparition de résistance aux pesticides et herbicides. Éliminer le SIDA. Tous ces souhaits semblent maintenant à portée de mains grâce à une nouvelle technique génétique appelée « gene drive », ou « forçage génétique » en français.
En ce moment, les médias parlent beaucoup de CRISPR, une technique révolutionnaire qui permet d'éditer facilement les gènes comme on le souhaite. CRISPR a été quasi-simultanément déclarée découverte scientifique de l’année 2015 et classée au rang des armes de destruction massive par la NSA1. Dans cet article, nous nous intéressons à l'application de CRISPR qui nous semble la plus préoccupante et néanmoins la moins mise en lumière : le « gene drive ». Nous nous interrogeons ici sur les implications et les risques liés au lâcher d'individus « gene drive » dans la nature.
« gene drive » : un puissant propulseur de mutations
Le « gene drive » est une technique de manipulation génétique qui permet de booster la propagation d'une mutation dans une population (Fig. 1). En relâchant simplement quelques individus qui possèdent une portion d'ADN élaborée par l'homme (appelée cassette « gene drive ») dans une population naturelle, on peut théoriquement obtenir en quelques dizaines de générations une population entièrement contaminée par la cassette « gene drive ». En introduisant au préalable dans la cassette « gene drive » la séquence d'ADN qui convient (conférant une résistance au parasite du paludisme par exemple), l'homme a donc maintenant les pouvoirs de transformer les espèces de la nature selon son bon vouloir : faire que les espèces invasives arrêtent d'envahir, que les plantes ne soient plus résistantes aux herbicides, que les humains soient résistants au virus du SIDA, etc.
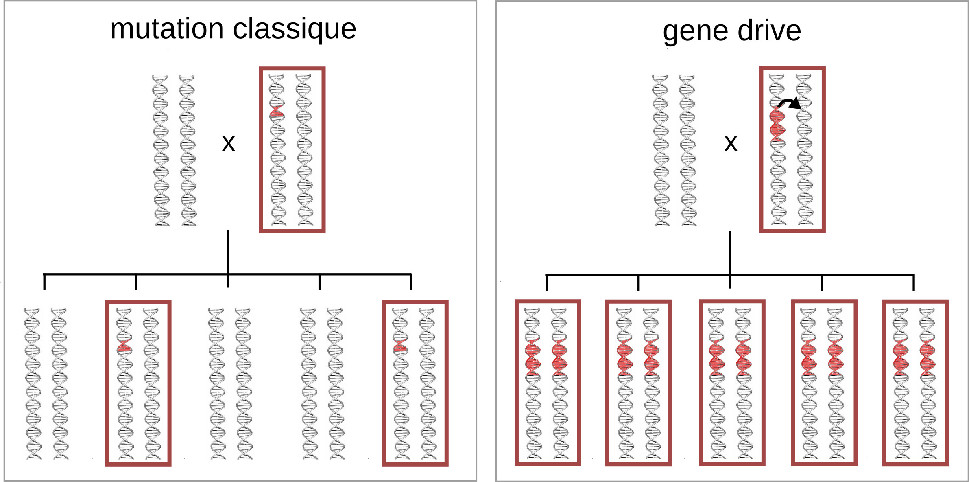
Fig. 1. Propagation d'une
mutation classique (à gauche) comparée à celle d'une
cassette gene drive (à droite).
Chaque individu est représenté schématiquement par une paire de chromosomes. Les individus portant la mutation rouge ou la cassette gene drive sont encadrés en rouge. |
En théorie, si 10 individus génétiquement modifiés et possédant une cassette d'ADN « gene drive » sont introduits dans une population naturelle de 100 000 individus, alors en moyenne plus de 99 % des individus seront porteurs de la cassette « gene drive » au bout de seulement 12-15 générations. A l'inverse, une mutation génétique présente dans les mêmes proportions aura disparu de la population au bout de quelques générations en moyenne, sauf si elle favorise le nombre de descendants.
Le mode de transmission du « gene drive » échappe aux lois de Mendel et permet ainsi de répandre en accéléré une modification particulière du génome dans l'ensemble d'une population d'individus à reproduction sexuée (avec mâles et femelles). D'autres éléments génétiques échappant aux lois de Mendel ont déjà été mis en évidence (les distorteurs de ségrégation, les éléments transposables, les éléments Médéa, les bactéries endocellulaires comme Wolbachia, et les endonucléases qui se copient elles-mêmes)2 mais le « gene drive » est beaucoup plus rapide et plus efficace que tous les autres mécanismes connus : il n'a pas d'effets collatéraux délétères sur les organismes qui le portent (contrairement aux quatre premiers cas) et il a une probabilité de transmission plus forte que les deux derniers.
Le « gene drive » manipule à son avantage les trois piliers de la sélection naturelle : mutation, hérédité et adaptation. Premièrement, les mutations n'apparaissent plus au hasard mais exactement là où le « gene drive » a été conçu pour couper, et la séquence d'ADN souhaitée est produite. Deuxièmement, alors qu'un parent transmet normalement la moitié de ses gènes à son enfant, un parent « gene drive » transmet la cassette « gene drive » à tous les coups. Troisièmement, un individu « gene drive » qui est mal adapté et qui devrait produire peu de descendants va tout de même transmettre ses gènes « gene drive » à la génération suivante du fait de son mode de transmission accru.
La cassette « gene drive » peut être assimilée à une mutation auto-amplifiante, qui s’auto-réplique elle-même et qui diffuse plus rapidement que par la génétique habituelle. Au regard de sa capacité à faire sauter les trois verroux caractéristiques du rythme évolutionnaire depuis 4 milliards d’années, le « gene drive » est probablement l’invention biologique la plus effective et imprédictible qu'on n'ait jamais possédée quant à la gestion du vivant, en nous et hors de nous.
Un dispositif génétique sans précédent dans l’histoire de l’évolution
Le « gene drive » met en jeu une cassette d'ADN qui contient 3 éléments : un gène qui code la protéine Cas-9, un gène qui code un ARN guide capable de reconnaître une séquence d'ADN cible bien particulière, et des séquences en bordure de la cassette qui permettent d'insérer la totalité de la cassette « gene drive » au site de coupure cible. En bref, la cassette se copie elle-même à un endroit souhaité dans le génome et diffuse ainsi automatiquement dans toute la descendance.
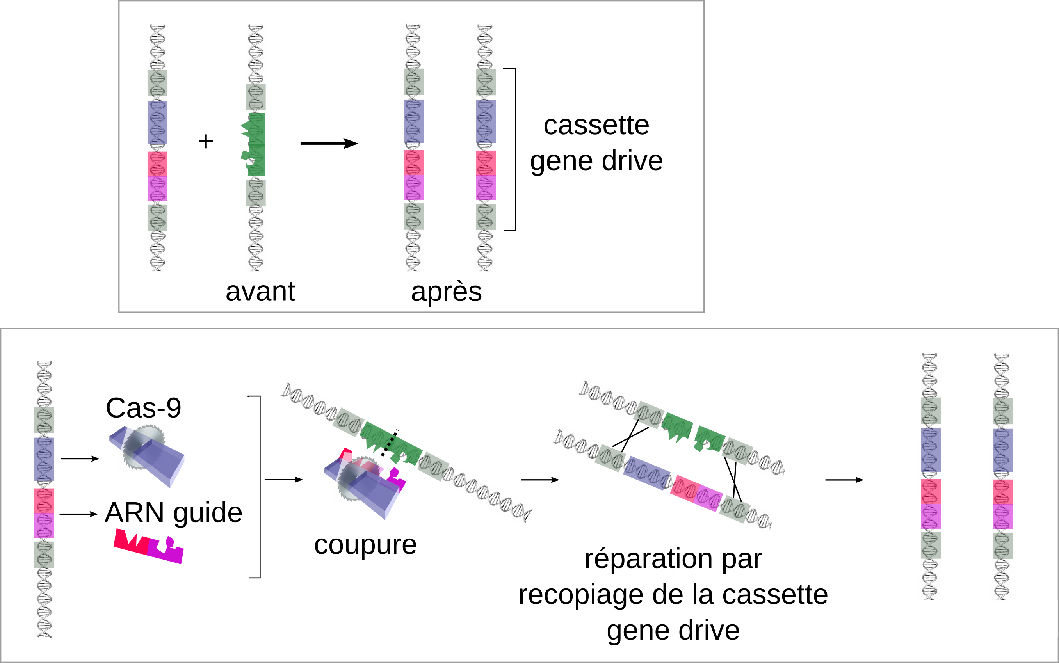
Une cassette gene drive contient quatre éléments : un gène codant la protéine Cas-9 (en bleu), un gène codant l'ARN guide (correspondant à un élément en rouge et un autre élément en rose) et des séquences flanquantes (en gris) permettant la reconnaissance du site ciblé et l'insertion d'une nouvelle cassette gene drive à l'endroit du site ciblé. La séquence de l'ARN guide est choisie de telle sorte que le complexe (Cas-9 + ARN guide) coupe l'ADN exactement au site ciblé. ©Virginie Orgogozo
Auparavant, dans la nature, les trois éléments de la cassette « gene drive » n'avaient jamais été combinés ensemble dans un ADN de taille minimale. Si les bactéries ont inventé Cas-9 pour supprimer les virus insérés dans leur génome, Cas-9 était néanmoins exprimé par une séquence indépendante de la séquence cible : la protéine était produite, allait scanner les chromosomes, puis couper la séquence d'ADN cible. Dans la cassette « gene drive », la séquence qui code Cas-9 est placée juste à côté de la séquence cible, ce qui fait que la cassette peut se découper elle-même et se déposer automatiquement dans les régions choisies sur les chromosomes. En fait, c'est même quatre éléments, localisés normalement à quatre endroits différents du génome, qui ont été combinés ensemble dans la cassette « gene drive » : l'équivalent de l'ARN guide correspond, chez les bactéries dans lesquelles le système de coupure Cas-9 a été identifié, à deux molécules d'ARN codées par deux gènes isolés. C'est la main de l'homme qui a, pour la première fois, rassemblé quatre éléments génétiques normalement dispersés dans le génome au sein d'une seule séquence d'ADN de taille minimale. La cassette ainsi produite constitue un dispositif génétique sans précédent qui s'auto-réplique lui-même.
Mais pourquoi la nature n'a pas inventé le « gene drive » ? Parce qu'il a fallu plusieurs millions d'années d'évolution pour que les microorganismes unicellulaires produisent un outil génétique efficace basé sur l'ARN leur permettant d'éradiquer les virus (CRISPR), et parce que l'homme a ensuite rendu ce système plus compact, et l'a importé dans des organismes à reproduction sexuée. Nous sommes en présence d'une cassette génétique aux propriétés très particulières, qui n'a jamais existé auparavant.
La méthode est splendide, et enchante les biologistes par sa beauté, sa simplicité et son efficacité. Cependant, il nous semble important de ne pas nous laisser aveugler par ce pouvoir soudain. Il convient de rester prudent afin de pouvoir soupeser correctement les arguments pour ou contre le « gene drive ».
Domestiquer tout le vivant
La technique « gene drive » marche chez toutes les espèces pour lesquelles elle a été testée : levures, moustiques, mouches, cellules humaines, etc.3 Alors que les techniques OGM « classiques » s'appliquent uniquement aux espèces domestiques qui peuvent être cultivées pendant plusieurs générations au laboratoire et qui peuvent se soumettre à des manipulations expérimentales complexes, il semble aujourd'hui possible de construire des individus « gene drive » de n'importe quelle espèce, du moment que l'on peut injecter un mélange bien choisi de protéines et d'ARNs dans l'embryon ou dans les organes reproducteurs de quelques individus sauvages prélevés puis relâchés dans la nature.
La domestication peut être définie comme la série d'opérations techniques qui façonnent et maintiennent un trait de caractère dans une population d'une espèce à l'avantage de l’espèce humaine, et non plus à celui de l'espèce concernée (comme c’est naturellement le cas dans l’évolution). Avec CRISPR et le « gene drive », le processus de domestication sort du champ restreint des espèces avec lesquelles on entretient des relations domesticatoires (soin, gestion, interaction) : le « gene drive » peut s'appliquer à tout le sauvage avec reproduction sexuée. Il s'agit donc ici, pour la première fois dans l’histoire de l’humanité, d'un pouvoir de domestication de la totalité du vivant. Jusqu'à hier, pour gérer les nuisibles et améliorer la productivité, on transformait le génome des semences. Désormais, on entend changer le génome des « nuisibles » eux-mêmes, pour qu’ils soient à notre avantage. On peut considérer les organismes génétiquement modifiés par CRIPR et « gene drive » comme les premiers OGM sauvages. Cette formule en apparence paradoxale entend qualifier pourtant précisément le statut nouveau de ces organismes dont le génome est modifié alors que l'on n'entretient avec eux aucune relation de domestication : ils sont modifiés par simple lâcher dans les populations naturelles de quelques individus au génome édité.
C'est le sens même de « naturel », ou
« sauvage » qui est remis en cause par CRISPR et le
« gene drive ». Les espèces naturelles ou sauvages étant ce qui existe par soi-même et pour
soi-même, ce qui résiste à notre stricte volonté, i. e. dont les
traits sont à son avantage et pas à notre avantage et à notre
usage (les nuisibles, les adventices, les espèces invasives,
mais surtout toute la biodiversité non domestiquée). Si on décide de
relâcher des individus « gene drive » dans la nature, il
faut être conscient que l'on se dirige alors vers un monde
différent, où l’on ne pourra plus regarder ce goéland, le moustique
de Camargue, la daurade dans l’assiette, les hêtres des forêts, les
fleurs dont les abeilles font le miel, sans ignorer si leur matériel génétique a été
manipulé imperceptiblement de main humaine à notre avantage (c’est-à-dire la plupart
du temps à l’avantage d’un groupe humain particulier). Avec
CRISPR et le « gene drive », on
possède désormais le pouvoir technique d’accomplir de main humaine et avec une indéniable
facilité ce que la métaphysique judéo-chrétienne prétendait
être le fait de Dieu : faire à notre usage et à notre
avantage n'importe quelle espèce, et potentiellement la
totalité de la Création (à l'exclusion des espèces non sexuées
sur lesquelles le « gene
drive » ne possède pas les mêmes effets
de diffusion non-mendélienne). Au moment
où la montée d’une conscience écologique plaide pour la
reconnaissance du droit fondamental des espèces sauvages à vivre
pour elles-mêmes, sans être détruites ou exploitées sans
discernement, on peut s’interroger sur les implications éthiques de
ce pouvoir. Le problème est par ailleurs que sous couvert
d’humanisme, ce pouvoir peut avant tout servir les intérêts
économiques particuliers de groupes peu soucieux de l’intérêt
général, comme on l’a vu au XXième siècle dans l’usage des
biotechnologies. C'est pourquoi la question de relâcher le
« gene drive » dans la nature ne comporte pas seulement
des risques écologiques et sanitaires réels, mais constitue aussi un
enjeu métaphysique, politique et économique. Les
problèmes éthiques soulevés par le « gene drive » et par
CRISPR sont ainsi beaucoup plus amples qu'avec les OGM classiques.
|
|
 Fig. 4. Moustique femelle Anopheles gambiae. Service
Imagerie et Reprographie Institut Pasteur.
|
Un outil puissant qui peut nous échapper
Quels sont les risques associés au « gene drive » ? Il existe deux types de risques : (a) les risques d'utilisation malveillante de la technique et (b) les effets collatéraux involontaires malgré une intention bienveillante. Les risques (a) doivent être pris en compte car aujourd'hui il peut être très facile et peu coûteux de construire des individus « gene drive » (quelques mois, ~1000 euros de produits de base). N’importe quelle coopérative agricole pourrait se doter d’un petit laboratoire et d’un biologiste renégat pour éditer le génome de ses nuisibles, sans même que ce soit reconnaissable ni isolable. La protéine Cas-9 est disponible en poudre pour quelques centaines d’euros sur internet.
Dans cet article, nous voulons insister
sur les risques (b), c'est-à-dire les effets collatéraux
imprévisibles d’une volonté bienveillante car ils présentent une
dimension préoccupante. Trois types de risques peuvent être
envisagés (voir encadré bleu). Tout
d'abord, le « gene drive » peut contaminer d'autres
populations (risque (1)). Pour évaluer ce
risque, il est nécessaire de connaître certains paramètres de
biologie moléculaire pure, qui sont inconnus pour l'instant (à notre
connaissance) : taille maximale de la cassette « gene
drive », longueur des séquences de bordure de la cassette et
pourcentage d'identité minimale requise avec les séquences ciblées
afin que la transmission « gene drive » ait lieu.
Trois risques majeurs non quantifiés du « gene drive »
| (1) une cassette « gene drive
» peut se répandre dans de nouvelles populations qui n'étaient
pas ciblées, suite à un phénomène d'hybridation ou de
transfert horizontal d'ADN. (2) si une séquence d'ADN étrangère s'insère par mégarde dans la cassette « gene drive » alors que la cassette n'est pas encore présente dans tous les individus de la population, alors cette séquence d'ADN étrangère va pouvoir se répandre comme une traînée de poudre, à la vitesse du « gene drive ». Si cette séquence apporte, par malchance, une résistance aux insecticides ou une meilleure attirance envers les odeurs humaines, alors la manipulation « gene drive » des moustiques peut se retourner contre nous. (3) Si les conséquences du « gene drive » sur les individus qui portent la cassette « gene drive » sont bien comprises, celles à l'échelle des écosystèmes sont extrêmement difficiles à estimer. |
Le risque (2), à savoir que la cassette « gene drive » soit utilisée par la nature comme un nouveau véhicule pour répandre rapidement de nouvelles mutations qui ont des effets néfastes pour les populations humaines, semble assez préoccupant. En effet, si, par mégarde, une séquence d'ADN étrangère s'insère dans la cassette « gene drive » alors que la cassette n'est pas encore présente dans tous les individus de la population, alors cette séquence d'ADN étrangère va pouvoir se répandre comme une traînée de poudre, à la vitesse du « gene drive ». Si cette séquence apporte, par malchance, une résistance aux insecticides ou une meilleure attirance envers les odeurs humaines, alors la manipulation « gene drive » des moustiques peut se retourner contre nous. Relâcher le « gene drive » dans la nature, c'est mettre à disposition de la nature des nouveaux propulseurs de mutations génétiques, pour le meilleur et pour le pire. Le « gene drive » n'est pas une simple entité physique, à la manière des pesticides ou des médicaments : il porte une information qui a des conséquences sur la nature, et cette information est capable, en dehors de notre contrôle, de se modifier, mélanger et se répandre. Un peu comme une phrase qu'on n'aurait pas voulu dire : une fois lâchée, on ne peut la récupérer.
Une fois les cassettes « gene drive » relâchées dans la nature, nous n'avons plus les moyens de les éradiquer. Alors qu'il est possible d'arrêter l'épandage d'herbicides, on ne peut pas éliminer les cassettes « gene drive » sans laisser de traces dans le génome. Pour maîtriser le « gene drive », il a été préconisé d'utiliser des cassettes « gene drive » garde-fous qui pourraient restaurer la séquence d'ADN originale, au cas où on veuille finalement arrêter le « gene drive ». Mais tous les garde-fous proposés jusqu'à présent (le dernier dans une publication de février 20164) laissent toujours une pseudo-cassette « gene drive » dans les individus. De plus, si un ADN qui confère un avantage aux porteurs s'est déjà inséré dans la cassette « gene drive », alors c'est trop tard : le « gene drive » garde-fou ne pourra pas contrer le processus car il ne sera pas aussi avantageux que le « gene drive » qu'on aimerait supprimer.
En conclusion, les garde-fous qui ont été proposés jusqu'à présent ne sont pas totalement convaincants. Le risque que la cassette « gene drive » nous échappe est réel : il ne doit pas être négligé.
Des effets nets et précis à l'échelle moléculaire, mais flous à l'échelle des écosystèmes
Au niveau moléculaire, les techniques CRISPR et « gene drive » sont extrêmement efficaces, précises et sans erreur. A cette hyper-maîtrise à l'échelle moléculaire s'oppose un savoir très hypothétique concernant les effets de « gene drive » à l'échelle des populations et des écosystèmes (risque (3)). Les biologistes qui ont mis au point la technologie « gene drive » sont des spécialistes de la biologie moléculaire. Ils ne connaissent ni l'écologie ni la dynamique des écosystèmes. Or il faut connaître les paramètres de dynamique démographique et de reproduction de la population en question si on veut modéliser l 'effet du « gene drive » dans cette population. Il faut aussi connaître ses relations écologiques complexes avec les autres espèces de la communauté biotique pour pouvoir estimer l'impact, à l'échelle de l'écosystème, d'un lâché d'individus « gene drive ». Malheureusement, ces paramètres ne sont connus pour aucune des espèces pour lesquelles la technique « gene drive » est envisagée.
Le terme « gene editing » est souvent employé pour parler de CRISPR, afin de souligner son efficacité et sa précision remarquable. Le fait même d’exercer un contrôle remarquable au niveau microscopique rend invisible l’absence de contrôle au niveau macroscopique, de l’organisme, de la population et de l'écosystème.
Les biologistes qui proposent dès maintenant et
sans analyse approfondie de relâcher des organismes « gene
drive » dans la nature ont une particularité : s'ils
connaissent bien l’échelle moléculaire des causes et de la
manipulation génétique, ils sont beaucoup plus ignorants à l’échelle
macroscopique des effets écologiques, là où se joueront les conséquences
importantes de l’action. Parce qu’ils sont la
plupart du temps biologistes moléculaires d’abord, mais surtout
parce que le niveau écosystémique est enchevêtré, et que les modèles
scientifiques pour prédire le devenir de ces systèmes complexes avec
exactitude sont encore manquants. En conséquence, les
biotechnologies CRISPR et « gene drive » confèrent
à ses manipulateurs, à l’égard du vivant, un
pouvoir de dieux myopes.
Ce qui manque aujourd’hui au débat scientifique sur le « gene drive », c’est une pensée relationnelle systémique et complexe, armée de l’humilité et la patience caractéristique des approches d’écologie scientifique. De même, il manque un débat éthique sur les conditions morales et les droits d’une domestication par les humains (au sens précis de transformation de leurs caractères à notre avantage) de toutes les espèces de la biosphère. C’est pour cela que les législateurs devraient mettre en place tous les dispositifs légaux nécessaires pour geler ou ralentir l’utilisation de ces dispositifs en condition réelle (car dans l’immense majorité des cas, il n’y a aucune urgence à appliquer ces techniques), ou les limiter drastiquement à des cas particuliers lorsque l’urgence est manifeste (le cas du paludisme5 exige un débat), pour donner le temps à la société civile de réfléchir collectivement à ce qu’elle veut faire de cet outil, avant que des intérêts particuliers peu prévoyants ne commettent des dommages irréparables à la biosphère.
Pour ou contre le lâcher de moustiques « gene drive » résistants au parasite Plasmodium pour éradiquer le paludisme ?
| POUR - moins cher que les techniques actuelles (élimination des points d'eau qui constituent les gîtes larvaires, moustiquaires, insecticides, vaccins, mâles stériles) - potentiellement plus rapide que les techniques actuelles - potentiellement plus efficace que les techniques actuelles CONTRE - la cassette « gene drive » peut échapper à notre contrôle (risques 1 et 2) - impacts sur l'écosystème non chiffrés (risque 3) - potentiellement moins efficace que prévu (apparition de gènes de résistances au « gene drive » dans les populations (ce risque a été relativement bien évalué par rapport aux autres risques et les chercheurs ont mis au point plusieurs moyens de s'affranchir de ce risque), réservoirs d'espèces cryptiques ou de populations qui ne s'hybrident pas avec les individus « gene drive » introduits) |
 Moustique
Anopheles gambiae
transgénique exprimant la protéine fluorescente YFP dans les
yeux. ©Émilie Pondeville Moustique
Anopheles gambiae
transgénique exprimant la protéine fluorescente YFP dans les
yeux. ©Émilie Pondeville |
Pourquoi le débat est urgent
2003 : premiers modèles théoriques du « gene drive » , mais les moyens génétiques de le faire n'existent pas6.
2012-2013 : développement de la technologie CRISPR : possibilité de couper l'ADN à n'importe quel site choisi grâce à seulement deux éléments : une protéine Cas-9 et un ARN guide (alors que les bactéries utilisent une protéine Cas-9 et deux ARN différents)7,8.
avril 2015 : 1ère publication sur d'organismes « gene drive », des mouches drosophiles de laboratoire9.
novembre 2015 : les premiers moustiques de laboratoire « gene drive » qui sont résistants au parasite vecteur du paludisme10.
décembre 2015 : les premiers moustiques de laboratoire « gene drive » qui sont femelle-stériles et qui pourraient permettre l'extinction des populations de moustiques11.
mars 2015 : l'OMS a accepté le relarguage de moustiques OGM Oxitec dans la nature12. Ces moustiques ont été produits par les techniques traditionnelles de manipulation génétique (sans CRISPR et sans « gene drive »).
Il est grand temps de réagir
La fondation Bill et Melinda Gates a déjà engagé plus de 40 millions de dollars pour essayer de fabriquer des moustiques « gene drive » qui permettraient d'éradiquer le paludisme13. La fondation Gates espère mettre au point la technologie et la laisser ensuite à disposition aux pays d'Afrique en leur laissant le choix de décider ou non si ils veulent prendre le risque de l'utiliser. Mais le « gene drive » ne respecte pas les frontières entre pays. La décision doit-elle être véritablement être prise à l'échelle d'un seul pays voire d'un seul continent ? Il est grand temps d'ouvrir le débat à l'échelle planétaire, en impliquant des scientifiques et des non scientifiques. Les enjeux ne sont pas seulement écologiques, sanitaires et civilisationnels : ils sont urgents.
Tweet
Références
1. Rapport de la NASA de février 2016 (p. 9).
2. Esvelt, K. M., Smidler, A. L., Catteruccia, F., & Church, G. M. (2014). Concerning RNA-guided gene drives for the alteration of wild populations. Elife, 3, e03401.
3. G. Church, interview du 30/03/2016, Edge.
4. Wu, B., Luo, L., & Gao, X. J. (2016). Cas9-triggered chain ablation of cas9 as a gene drive brake. Nature biotechnology, 34(2), 137-138.
6. Burt, A. (2003). Site-specific selfish genes as tools for the control and genetic engineering of natural populations. Proceedings of the Royal Society of London B: Biological Sciences, 270(1518), 921-928.
7. Mali, P., Yang, L., Esvelt, K. M., Aach, J., Guell, M., DiCarlo, J. E., ... & Church, G. M. (2013). RNA-guided human genome engineering via Cas9. Science, 339(6121), 823-826.
8. Cong, L., Ran, F. A., Cox, D., Lin, S., Barretto, R., Habib, N., ... & Zhang, F. (2013). Multiplex genome engineering using CRISPR/Cas systems. Science, 339(6121), 819-823.
9. Gantz, V. M., & Bier, E. (2015). The mutagenic chain reaction: a method for converting heterozygous to homozygous mutations. Science, 348(6233), 442-444.
10. Gantz, V. M., Jasinskiene, N., Tatarenkova, O., Fazekas, A., Macias, V. M., Bier, E., & James, A. A. (2015). Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences, 112(49), E6736-E6743.
13. Regalado A, The Extinction Invention. MIT Technology Review. 13 avril 2016.